L'analyse d'eau en détail
Introduction
Cette page contient les éléments d'analyse nécessaires aux applications d'échange d'ions. Ils sont moins nombreux que ceux destinés à évaluer la qualité d'une eau potable.
 Les caractéristiques générales de l'eau à traiter sont décrites dans une autre page, avec les limites recommandées pour certains contaminants et paramètres. Nous présentons ici l'analyse de détail des substances minérales dissoutes dans l'eau.
Les caractéristiques générales de l'eau à traiter sont décrites dans une autre page, avec les limites recommandées pour certains contaminants et paramètres. Nous présentons ici l'analyse de détail des substances minérales dissoutes dans l'eau.
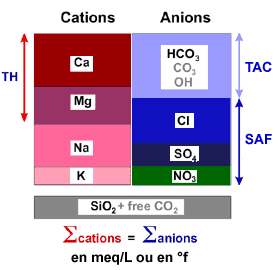
L'image de droite (cliquez pour l'agrandir) montre seulement les composants que l'on trouve dans la plupart des eaux de surface ou de forage, et qui sont importants pour le procédé d'échange d'ions.
Traditionnellement, on regroupe certaines de ces substances :
| Ca++ + Mg++ | = TH |
| HCO3– + CO3= + OH– | = TAC |
| Cl– + SO4= + NO3– | = SAF |
- Le calcium et le magnésium constituent la dureté totale (TH = titre hydrotimétrique, Total Hardness en anglais).
- Le bicarbonate, le carbonate et l'hydroxyde forment l'alcalinité (TAC = titre alcalimétrique complet). Néanmoins, les eaux naturelles ne contiennent généralement pas de carbonate ou d'hydroxyde.
- Le chlorure, le sulfate et le nitrate forment les sels d'acides forts (SAF), également appelés titre acidimétrique fort (TAF ou Taci) après échange de cations.
- Lorsque la dureté est (en meq/L) plus grande que l'alcalinité, la dureté associée au bicarbonate est appelée "dureté temporaire" (= TH – TAC) et la dureté restante est appelée "dureté permanente". Dans ce cas, la dureté temporaire est numériquement égale (en meq/L) au TAC.
- Lorsque la dureté est inférieure à l'alcalinité (en meq/L) il n'y a pas de dureté permanente, et la dureté temporaire est égale à la dureté totale.
- Toutes les eaux naturelles sont équilibrées ioniquement, ce qui veut dire que la somme des cations est égale à la somme des anions en meq/L.
D'autres ions, le plus souvent à l'état de traces mais parfois non négligeables, peuvent être combinés aux éléments ci-dessus :
- le baryum (Ba++) et le strontium (Sr++) sont des métaux alcalino-terreux (voir la note importante ci-dessous) et font donc partie de la dureté;
- pour le calcul d'une installation à l'aide d'un logiciel d'échange d'ions, on ajoute souvent le fer divalent (Fe++), le nickel (Ni++) et le cuivre (Cu++) à la dureté;
- l'ammonium (NH4+) et le potassium (K+) sont traités comme le sodium;
- le lithium (Li+) réagit aussi comme le sodium (Na+);
- le phosphate (PO43–) appartient au groupe SAF;
- le fluorure (F–), le bromure (Br–) et l'iodure (I–) sont des halogènes et se comportent comme le chlorure.
Il faut se rappeler que les résines standard on une faible affinité pour certains de ces ions, tels que le lithium et le fluorure. Par ailleurs, d'autres éléments, tels que l'aluminium, l'arsenic et de nombreux autres métaux peuvent exister sous forme de complexes et se comporter comme des anions; leur élimination est parfois difficile.
Le baryum et le strontium réagissent comme suit dans une réaction d'échange d'ions :
- La solubilité du sulfate de baryum n'est que de 2 mg/L, mille fois plus basse que celle du sulfate de calcium.
- Ba et Sr ne sont pas bien éliminés par une résine WAC (faiblement acide). Ce type de résine a une affinité plus faible pour Ba et Sr que pour Ca et Mg. Voir la table des valeurs de sélectivité.
- Ba (et Ra, le radium qui fait aussi partie du groupe des alcalino-terreux) s'éliminent facilement sur une résine SAC (fortement acide) du fait de leur forte affinité. Le revers de la médaille est que cette affinité est si forte que la régénération devient problématique. Par ailleurs l'usage d'acide sulfurique H2SO4 pour régénérer une telle résine chargée — même partiellement — avec du baryum est quasiment impossible.
Voir aussi la page (sans relation directe) sur l'eau de mer.
Unités de concentration et de capacité
Comme nous avons besoin de connaître le nombre des ions à échanger — leur masse n'est guère utile ici — la concentration de ces ions doit être convertie en unités "équivalentes" ; l'unité internationale correspondante est eq·kg–1. On utilise généralement en pratique les "équivalents par litre" eq/L, et pour les concentrations faibles habituellement trouvées en traitement d'eau, on utilise meq/L. D'autres unités sont toujours en cours dans certaines régions du monde :
| Nom | Abréviation | meq/L | |
|---|---|---|---|
| ppm de carbonate de calcium | 1 ppm as CaCO3 | = | 0,02 |
| Degré français | 1 °f | = | 0,2 |
| Degré allemand de dureté | 1 °dH | = | 0,357 |
| Grain de CaCO3 par gallon US | 1 gr as CaCO3/gal | = | 0,342 |
| Nom | Abréviation | eq/L | |
|---|---|---|---|
| Gramme de CaCO3 par litre | 1 g as CaCO3/L | = | 0,02 |
| Degré français | 1 °f | = | 0,0002 |
| Gramme de CaO par litre | g CaO/L | = | 0,0357 |
| Kilograin de CaCO3 par pied cube | kgr CaCO3/ft3 | = | 0,0458 |
Une table de conversion complète en anglais peut être consultée dans une fenêtre séparée.
Il est préférable d'éviter absolument les moles pour l'échange d'ions, car cette unité ne tient pas compte de la valence et conduit à des erreurs. Rappelez-vous : 1 eq = 1 mole / valence.
Pour ceux qui sont curieux, une mole contient 6,02×1023 atomes, ions ou molécules. Ce nombre gigantesque est appelé constante d'Avogadro.
Note : en Allemagne et dans certains pays d'Europe centrale et orientale, on utilise mval/L et val/L au lieu de meq/L et eq/L.
Exemples
La table suivante montre les ions communément présents en traitement d'eau et leur masse équivalente.
| Nom | Ion | g/mole | g/eq |
|---|---|---|---|
| Calcium | Ca++ | 40 | 20 |
| Magnésium | Mg++ | 24 | 12 |
| Sodium | Na+ | 23 | 23 |
| Potassium | K+ | 39 | 39 |
| Ammonium | NH4+ | 18 | 18 |
| Chlorure | Cl– | 35,5 | 35,5 |
| Sulfate | SO4= | 96 | 48 |
| Nitrate | NO3– | 62 | 62 |
| Bicarbonate | HCO3– | 61 | 61 |
| Carbonate | CO3= | 60 | 30 |
Dans l'eau, les concentrations sont exprimées en meq/L. Par exemple, si vous avez une concentration de calcium de 90 mg/L, la concentration équivalente est de 90/20=4,5 meq/L.
La silice (SiO2), qui n'est pas ionisée dans l'eau naturelle, a une masse molaire de 60. En échange d'ions — avec une résine fortement basique sous forme OH — on considère la silice comme monovalente, donc avec une masse équivalente de 60 également.
L'acide carbonique (ou dioxyde de carbone CO2 appelé communément gaz carbonique) est très légèrement ionisé dans une eau naturelle, et on le considère aussi comme monovalent, avec une masse équivalente de 44. L'équilibre entre CO2 et HCO3 est présenté au bas de cette page.
Ne tombez pas dans le piège suivant : 1 équivalent de CaCO3 (50 g), par exemple, contient 1 eq de Ca (20 g) et 1 eq de CO3 (30 g). On n'additionne pas les deux (1 eq cation et 1 eq anion) : il n'y a toujours qu'un seul équivalent de CaCO3, pas 2 !
Une analyse équilibrée ?
L'eau est électriquement neutre, même lorsqu'elle contient une grande quantité d'ions, comme dans la mer. Ceci signifie que le nombre de charges anioniques est exactement égal au le nombre de charges cationiques. Si tel n'était pas le cas, vous recevriez un choc électrique en plongeant votre main dans l'eau ! Par conséquent, une fois que vous avez converti soigneusement les éléments d'une analyse d'eau en meq/L, la somme des anions doit être égale à la somme des cations. Les seules exceptions à cette règle sont :
- Une petite différence due à l'imprécision des méthodes d'analyse est inévitable, et acceptable tant que la différence entre le total des cations et le total des anions est inférieure à disons 3 %.
- À pH élevé (> 8,2), en présence d'ammoniaque ou après décarbonatation à la chaux, il y a des ions hydroxyde ou carbonate, et l'hydroxyde — et parfois le carbonate — ne sont pas toujours rapportés dans l'analyse, mais si vous avez une valeur de TAC, l'analyse doit être équilibrée même à pH 10.
- À pH acide (disons < 6,8), l'eau peut contenir de l'acidité libre — ce qui est très rare pour une eau naturelle — ou, plus souvent, du gaz carbonique libre, lesquels produisent des ions H+ qui ne sont généralement pas rapportés dans l'analyse.
Un exemple d'analyse d'eau
Voici une analyse telle qu'il faut la présenter pour le calcul d'une installation d'échangeurs d'ions (adoucissement, déminéralisation, décarbonatation, dénitratation). C'est une eau de rivière réelle (1), provenant de l'Oise en France, et l'analyse est datée du 28 septembre 2005.
| Cations | mg/L | meq/L | Anions | mg/L | meq/L |
| Ca++ | 93 | 4,65 | Cl– | 67 | 1,89 |
| Mg++ | 12 | 1,00 | SO4= | 33 | 0.69 |
| Na+ | 26 | 1,13 | NO3– | 6 | 0,10 |
| K+ | 4 | 0,10 | HCO3– | 259 | 4,23 |
| Total cations | 6,90 | Total anions | 6,91 | ||
| SiO2 | 2,4 | 0,04 | |||
| pH | 7,04 | CO2 libre | 45 | 1,02 | |
| Conductivité µS/cm | 627 | Charge anionique | 7,97 | ||
| Matières organiques (2) | 2,6 | ||||
| Température °C | 16 | ||||
(2) Les matières organiques (DCO) sont importantes, car elles peuvent empoisonner les résines échangeuses d'anions. Elles sont traditionnellement exprimées en mg/L de KMnO4.
L'analyse ci-dessus est assez typique d'une eau d'Europe occidentale, avec une teneur relativement élevée en dureté et en alcalinité, et peu de silice. La silice et le gaz carbonique libre sont éliminés par la résine fortement basique dans une installation de déminéralisation. Néanmoins, le gaz carbonique peut être réduit fortement par un dégazeur atmosphérique ou à membrane installé après l'échangeur de cations pour réduire la charge anionique.
TAC et TA
L'alcalinité comprend les anions suivants :
- Hydrogénocarbonate HCO3–, souvent appelé bicarbonate
- Carbonate CO3=
- Hydroxyde OH–
- La phénolphthaléine qui vire à pH 8,3 mesure le TA (titre alcalimétrique, p-alkalinity en anglais)
- Le méthylorange qui vire à pH 4,5 mesure TAC (titre alcalimétrique complet, m-alkalinity en anglais)
HCO3– + OH–  CO3= + H2O
CO3= + H2O
Selon la valeur du pH en ordre croissant, nous aurons dans l'eau soit seulement du bicarbonate, soit un mélange de bicarbonate et de carbonate, soit un mélange de carbonate et d'hydroxyde, soit seulement de l'hydroxyde. Ceci se retrouve dans la table suivante :
| Ion | TA = 0 | TA < TAC/2 | TA = TAC/2 | TAC/2 < TA < TAC | TA = TAC | |
| OH | = | 0 | 0 | 0 | 2 TA - TAC | p |
| CO3 | = | 0 | 2 TA | TAC = 2 TA | 2 (TAC - TA) | 0 |
| HCO3 | = | TAC | TAC - 2 TA | 0 | 0 | 0 |
Les valeurs de cette table sont exprimées en unités équivalentes, donc en meq/L ou éventuellement en mg/L de CaCO3, en degrés français ou allemands, mais pas en mol/L ou mg/L !
Examinons des exemples pour une eau dont le TAC est de 5 meq/L, avec pH croissant :
| Exemple 1 | TAC = 5 | TA = 0 |
|---|---|---|
| OH = 0 | CO3 = 0 | HCO3 = 5 |
| Exemple 2 | TAC = 5 | TA = 1,5 |
| OH = 0 | CO3 = 3 | HCO3 = 2 |
| Exemple 3 | TAC = 5 | TA = 3 |
| OH = 1 | CO3 = 4 | HCO3 = 0 |
Lorsque le TA est positif, ce qui correspond à un pH supérieur à 8,3, il n'y a pas de CO2 libre, car il se combinerait avec CO3 pour produire du HCO3 :
CO2 + CO3= + H2O  2 HCO3–
2 HCO3–
CO2 libre et pH
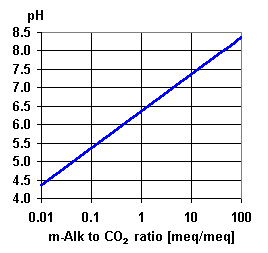 Une valeur basse de pH signifie qu'il y a des ions H+ en solution. En présence de bicarbonate, l'équilibre suivant se produit :
Une valeur basse de pH signifie qu'il y a des ions H+ en solution. En présence de bicarbonate, l'équilibre suivant se produit :
H+ + HCO3– 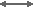 H2CO3
H2CO3 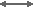 CO2 + H2O
CO2 + H2O
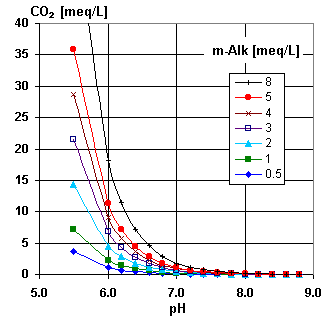
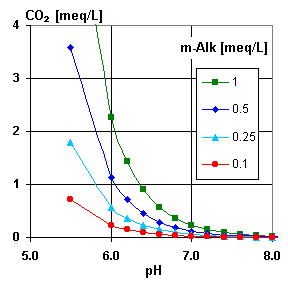
Les deux graphiques illustrent cet équilibre. Utilisez le second graphique pour vérifier que l'analyse donnée par votre client est correcte, et pour estimer la concentration de gaz carbonique libre s'il n'est pas inclus dans l'analyse. Vous voyez sur le graphique qu'à un pH supérieur à 7,2, il n'y a pratiquement pas de CO2.
Lorsque l'on traite par échange d'ions un perméat d'osmose inverse, cette relation est très importante, car le CO2 constitue souvent la part majeure de la charge anionique sur les résines. Dans ce cas, vous pouvez utiliser le troisième graphique, qui est un agrandissement du précédent pour de faibles concentrations.
Pour mémoire (comme les graphiques sont en anglais) : m-Alk = TAC.