El análisis de agua con detalles
Introducción
Esta página contiene los elementos de análisis necesarios para aplicaciones de intercambio iónico. Son mucho más sencillos que los requeridos para establecer la calidad de un agua potable.
 Las características generales del agua bruta se encuentran en otra página en inglés, con límites recomendados de algunos contaminantes y parámetros. Presentamos aquí los detalles del análisis de las sustancias disueltas en el agua.
Las características generales del agua bruta se encuentran en otra página en inglés, con límites recomendados de algunos contaminantes y parámetros. Presentamos aquí los detalles del análisis de las sustancias disueltas en el agua.
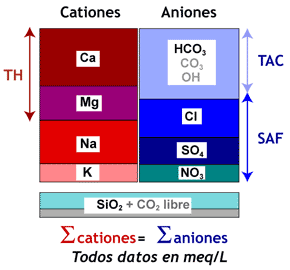
La imagen de la derecha (haga click para alargarla) contiene solo los iones y compuestos encontrados en la mayoría de los aguas de río o de pozo y que son importantes para el proceso de intercambio iónico.
Se agrupan tradicionalmente estas sustancias:
| Ca++ + Mg++ | = TH |
| HCO3– + CO3= + OH– | = TAC |
| Cl– + SO4= + NO3– | = SAF |
- El calcio y el magnesio forman la dureza total (TH = título hidrotimétrico, Total Hardness en inglés).
- El bicarbonato, el carbonato y el hidróxido forman la alcalinidad (TAC = título alcalimétrico completo) aunque en general las aguas naturales no contienen carbonato o hidróxido.
- El cloruro, el sulfato y el nitrato forman las sales de ácidos fuertes (SAF), llamado también título acidimétrico (TAF o Taci) después del intercambio catiónico.
- Cuando la dureza es mayor que la alcalinidad (en meq/L), la dureza asociada con el bicarbonato se llama dureza temporal (= TH – TAC), y lo demás se llama dureza permanente. En este caso, el valor de dureza temporal en meq/L es igual al valor de TAC.
- Cuando la dureza es menor que la alcalinidad (en meq/L) no hay dureza permanente y la dureza temporal es numéricamente igual a la dureza total.
- Todas las aguas naturales son equilibradas iónicamente, lo que quere decir que la suma de los cationes es igual a la suma de los aniones en meq/L.
Otros iones, muchas veces en trazas, pero a veces no insignificantes, se pueden combinar con las sustancias presentadas arriba:
- el bario (Ba++) y el estroncio (Sr++) son metales alcalinotérreos (véase el comentario abajo) y son componentes de la dureza;
- en el cálculo de una planta con un software de intercambio iónico, se añaden a la dureza el hierro divalente (Fe++), el níquel (Ni++) y el cobre (Cu++);
- el amonio (NH4+) y el potasio (K+) se tratan como el sodio;
- el litio (Li+) también reacciona como el sodio (Na+);
- el fosfato (PO43–) es un componente del grupo SAF;
- el fluoruro (F–), el bromuro (Br–) y el ioduro (I–) son halógenos y se tratan como el cloruro.
Hay que recordar que las resinas comunes tienen una afinidad baja para algunos de estos iones, como el litio o el fluoruro. Además, otros elementos como el aluminio, el arsénico y muchos metales pueden existir en forma de complejos y su eliminación es a veces difícil.
El bario y el estroncio reaccionan de la manera siguiente en un intercambio iónico:
- La solubilidad del sulfato de bario es solo unos 2 mg/L, es decir mil veces más baja que la del sulfato de calcio.
- Ba y Sr no se eliminan bien con una resina débilmente ácida (WAC). Este tipo de resina tiene una afinidad menor para Ba y Sr que para Ca y Mg. Véase la tabla de selectividad.
- Ba (y Ra, el radio que también es parte del grupo de los alcalinotérreos) se eliminan fácilmente con una resina fuertemente ácida (SAC) por su alta afinidad. Por otro lado, esta afinidad es tan fuerte que la regeneración de la resina es problemática. Además, el uso de ácido sulfúrico H2SO4 para regenerar una resina SAC cargada —aun parcialmente— con bario es casi imposible.
Véase también (sin relación directa con eso) la página sobre el agua de mar.
Unidades de concentración y de capacidad
Deseamos conocer el número de iones que queremos cambiar. Su masa no es útil para el cálculo. Entonces, tenemos que convertir las concentraciones de estos iones en unidades "equivalentes"; la unidad internacional correspondiente es el eq·kg–1, y en la práctica se usa el equivalente por litro de agua eq/L, y con concentraciones bajas —las que se encuentran en el tratamiento de agua— el meq/L. Otras unidades existen en algunas partes del mundo:
| Nom | Abreviación | meq/L | |
|---|---|---|---|
| ppm de carbonato de calcio | 1 ppm as CaCO3 | = | 0,02 |
| Grado francés | 1 °f | = | 0,2 |
| Grado alemán de dureza | 1 °dH | = | 0,357 |
| Grain de CaCO3 por galón US | 1 gr as CaCO3/gal | = | 0,342 |
| Nombre | Abreviación | eq/L | |
|---|---|---|---|
| Grama de CaCO3 por litro | 1 g as CaCO3/L | = | 0,02 |
| Grado francés | 1 °f | = | 0,0002 |
| Grama de CaO por litro | g CaO/L | = | 0,0357 |
| Kilograin de CaCO3 por pié cúbico | kgr CaCO3/ft3 | = | 0,0458 |
Una tabla de conversión completa se puede consultar en una ventana separada.
Es recomendable evitar totalmente los moles en el intercambio iónico, porque esta unidad no toma en cuenta la valencia y produce errores. Recordemos que
1 eq = 1 mol / valencia.
Para los curiosos, un mol contiene 6,02×1023 átomos, iones o moléculas. Este número enorme se llama número de Avogadro.
En Alemania y en ciertos paises de Europa central y oriental, se usan mval/L y Val/L en lugar de meq/L y eq/L.
Ejemplos
La tabla siguiente contiene los iones generalmente encontrados en el tratamiento de agua y su masa equivalente.
| Nombre | Ion | g/mol | g/eq |
|---|---|---|---|
| Calco | Ca++ | 40 | 20 |
| Magnesio | Mg++ | 24 | 12 |
| Sodio | Na+ | 23 | 23 |
| Potasio | K+ | 39 | 39 |
| Amonio | NH4+ | 18 | 18 |
| Cloruro | Cl– | 35,5 | 35,5 |
| Sulfato | SO4= | 96 | 48 |
| Nitrato | NO3– | 62 | 62 |
| Bicarbonato | HCO3– | 61 | 61 |
| Carbonato | CO3= | 60 | 30 |
En el agua, las concentraciones se expresan en meq/L. Por ejemplo, si tenemos una concentración de calcio de 90 mg/L, la concentración equivalente es de 90/20=4,5 meq/L.
La sílice (SiO2), no ionizada en el agua natural, tiene una masa molar de 60. En el proceso de intercambio iónico con una resina fuertemente básica en forma OH, la sílice se considera como monovalente, es decir con una masa equivalente de 60 también.
El ácido carbónico (dióxido de carbón o gas carbónico) está débilmente ionizado en las aguas naturales y se toma también como monovalente con una masa equivalente de 44. Se presenta el equilibrio entre CO2 y HCO3 al final de esta página.
No caiga en la trampa siguiente: 1 equivalente de CaCO3, por ejemplo, tiene 1 eq de Ca (20 g) y 1 eq de CO3. ¡No se adicionan: 1 eq de cationes y 1 eq de aniones quedan 1 equivalente y no 2!
¿Un análisis equilibrado?
El agua natural es eléctricamente neutral, aun cuando contiene grandes cantidades de iones, como el agua de mar. Eso significa que el número de cargas aniónicas es exactamente igual al número de cargas catiónicas. Si no fuese el caso recibiríamos un choque eléctrico sumergiendo nuestra mano en el agua! Por consiguiente, una vez convertidos los elementos de un análisis de agua en meq/L, la suma de los aniones debe ser igual a la suma de los cationes. Las únicas excepciones de esta regla son:
- Una diferencia pequeña debida a la falta de precisión de los métodos analiticos es inevitable y aceptable siempre que la diferencia entre cationes y aniones sea menor que digamos 3 %.
- Con un valor de pH alto (> 8,2), en presencia de amoníaco o después de una descarbonatación con cal, existen iones hidróxido o carbonato, cuyas concentraciones no se encuentran siempre en el análisis, pero si tenemos un valor de TAC, este análisis debe ser equilibrado aun con un pH de 10 o más.
- Con un valor de pH ácido, (digamos < 6,8) el agua puede contener acidez libre —lo que es muy raro con aguas naturales— o, más frecuentemente, ácido carbónico libre. Ambos producen iones H+ que generalmente no aparecen en el análisis de agua.
Un ejemplo de análisis de agua
He aquí un análisis tal como se debe presentar para el cálculo de una planta de intercambio iónico (ablandamiento, desmineralización, descarbonatación, denitratación). Es un agua de río real, procediente del río Oise en Francia, con fecha del 28 de septiembre de 2005.
| Cationes | mg/L | meq/L | Aniones | mg/L | meq/L |
| Ca++ | 93 | 4,65 | Cl– | 67 | 1,89 |
| Mg++ | 12 | 1,00 | SO4= | 33 | 0.69 |
| Na+ | 26 | 1,13 | NO3– | 6 | 0,10 |
| K+ | 4 | 0,10 | HCO3– | 259 | 4,23 |
| Total cationes | 6,90 | Total aniones | 6,91 | ||
| SiO2 | 2,4 | 0,04 | |||
| pH | 7,04 | CO2 libre | 45 | 1,02 | |
| Conductividad µS/cm | 627 | Carga aniónica | 7,97 | ||
| Materia orgánica (2) | 2,6 | ||||
| Temperatura °C | 16 | ||||
(2) Las materias orgánicas (DQO) son importantes, puesto que pueden envenenar las resinas intercambiadoras de aniones. Tradicionalmente se expresan en mg/L como KMnO4.
El análisis de arriba es típico de un agua de Europa occidental, con concentraciones relativamente altas de dureza y de alcalinidad, y poca sílice. La sílice y el gas carbónico se eliminan con resinas fuertemente básicas en una planta de desmineralización. No obstante, el gas carbónico se puede eliminar en gran parte con una torre de desgasficación atmosférica o de membranas después del intercambio de cationes para reducir la carga aniónica.
TAC y TA
La alcalinidad incluye los aniones siguientes:
- Bicarbonato HCO3–, también llamado hidrogenocarbonato
- Carbonato CO3=
- Hidróxido OH–
- La fenolftaleina, que vira a un pH de 8,3 mide el TA (título alcalimétrico, p-alkalinity en inglés)
- El naranja de metilo, que vira a un pH de 4,5 mide el TAC (título alcaimétrico completo, m-alkalinity en inglés)
HCO3– + OH–  CO3= + H2O
CO3= + H2O
Según el valor creciente del pH, tendremos en el agua o solo bicarbonato, o una mezcla de bicarbonato y de carbonato, o una mezcla de carbonato y de hidróxido, o solo hidróxido, como se puede ver en la tabla siguiente:
| Ion | TA = 0 | TA < TAC/2 | TA = TAC/2 | TAC/2 < TA < TAC | TA = TAC | |
| OH | = | 0 | 0 | 0 | 2 TA - TAC | p |
| CO3 | = | 0 | 2 TA | TAC = 2 TA | 2 (TAC - TA) | 0 |
| HCO3 | = | TAC | TAC - 2 TA | 0 | 0 | 0 |
Los valores de esta tabla son en unidades equivalentes, es decir en meq/L o posiblemente en mg/L de CaCO3, en grados franceses o alemanes, pero no en mol/L o en mg/L.
Miremos ahora ejemplos de un agua cuyo TAC es de 5 meq/L, con pH creciente:
| Ejemplo 1 | TAC = 5 | TA = 0 |
|---|---|---|
| OH = 0 | CO3 = 0 | HCO3 = 5 |
| Ejemplo 2 | TAC = 5 | TA = 1,5 |
| OH = 0 | CO3 = 3 | HCO3 = 2 |
| Ejemplo 3 | TAC = 5 | TA = 3 |
| OH = 1 | CO3 = 4 | HCO3 = 0 |
Cuando el TA es positivo, lo que corresponde a un pH de más de 8,3, no hay CO2 libre, puesto se combinaría con CO3 para producir HCO3:
CO2 + CO3= + H2O  2 HCO3–
2 HCO3–
CO2 libre y pH
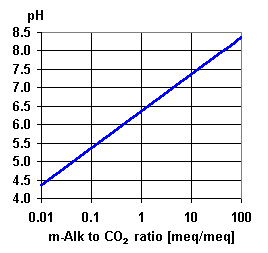 Un valor bajo de pH significa que hay iones H+ en solución. En presencia de bicarbonato se produce el equilibrio siguiente:
Un valor bajo de pH significa que hay iones H+ en solución. En presencia de bicarbonato se produce el equilibrio siguiente:
H+ + HCO3– 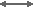 H2CO3
H2CO3 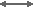 CO2 + H2O
CO2 + H2O
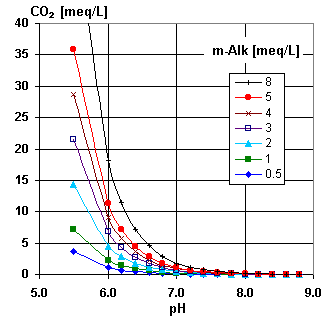
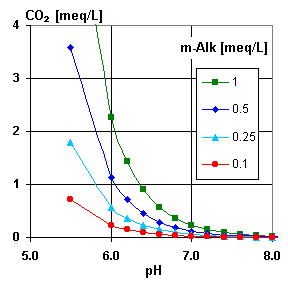
Ambos gráficos ilustran este equilibrio. Se puede usar el segundo gráfico para averiguar que el análisis proporcionado por el cliente es correcto, y para estimar la concentración de ácido carbónico libre si no es incluido en el análisis. Vemos en el gráfico que con un pH de más de 7,2 casi no hay CO2.
En caso del tratamiento de un permeado de ósmosis inversa, esta relación es muy importante, porque el CO2 es muchas veces la mayor parte de la carga aniónica. En este caso se puede utilizar el tercer gráfico que vale para concentraciones bajas.
Recordemos que (los gráficos son en inglés): m-Alk = TAC.