Grundlagen des Ionenaustauschs
Einführung
 Ionenaustausch ist ein leistungsfähiges chemisches Verfahren, welches der Allgemeinheit wenig bekannt ist. Diese einfache Abhandlung ist ein Versuch, den Ionenaustausch für diejenigen, die in der Chemie nur oberflächliche Kenntnisse haben, zu beschreiben.
Ionenaustausch ist ein leistungsfähiges chemisches Verfahren, welches der Allgemeinheit wenig bekannt ist. Diese einfache Abhandlung ist ein Versuch, den Ionenaustausch für diejenigen, die in der Chemie nur oberflächliche Kenntnisse haben, zu beschreiben.
Wenn meine Freunde fragen was ich beruflich mache antworte ich: "Ionenaustausch". Die meisten haben keine Ahnung. Jedoch haben — insbesondere in Westeuropa — sehr viele Menschen Ionenaustauscherharze zu Hause. Daher stelle ich dann eine Gegenfrage: "Warum glaubst du, muss Salz in die Geschirrspülmaschine zugegeben werden?" Nur wenige kennen die richtige Antwort. Wenn Sie auch dazugehören, werden Sie sie weiter unten entdecken.
Wasser
 Wasser sieht oberflächlich betrachtet einfach aus: es besteht aus Wassermolekülen (Formel: H2O). Sie wissen jedoch, dass diese einfache Vorstellung in der Wirklichkeit komplexer ist. Sonst würden Produzenten von Mineral- und Tafelwasser nicht so viel über dessen Mineralisierung schwärmen.
Wasser sieht oberflächlich betrachtet einfach aus: es besteht aus Wassermolekülen (Formel: H2O). Sie wissen jedoch, dass diese einfache Vorstellung in der Wirklichkeit komplexer ist. Sonst würden Produzenten von Mineral- und Tafelwasser nicht so viel über dessen Mineralisierung schwärmen.
In der Natur enthält Wasser immer Fremdstoffe — also nicht nur H2O — aber gewöhnlich nur in kleinen Mengen. Das Flusswasser, oder das Wasser, das aus dem Hahn in Ihrer Wohnung fließt, enthält ein bisschen von:
- festen, unlöslichen Substanzen, wie Sand, Eisenoxyd oder Pflanzenreste. Im Prinzip können diese ausfiltriert werden — und werden von der Wasserversorgung tatsächlich auch entfernt.
- gelösten Substanzen, welche gewöhnlich unsichtbar sind und nicht filtriert werden können. Diese können anorganische oder organische Verbindungen sein. Sie können sowohl ionisiert (elektrisch geladen) als auch nicht ionisiert sein.
Die löslichen nicht ionisierten Stoffe existieren im Wasser als Moleküle in verschiedenen Größen und mit unterschiedlichen chemischen Formeln, zum Beispiel:
- Kohlendioxid ist ein kleines Molekül mit einer einfachen Formel: CO2.
- Zucker ist eine größere Verbindung mit einer komplizierteren Formel, abgekürzt C12H22O11. Möchten Sie die dreidimensionale Formel sehen?
Möchten Sie diese Fremdstoffe aus dem Wasser entfernen? Nur Wasser mit ionisierten Substanzen kann mit Ionenaustausch behandelt werden. Zuckerarten z.B. werden nicht von Ionenaustauscherharzen aus Lösungen entfernt.
Ionen
Die im Wasser ionisierten Stoffe existieren als Ionen. Diese sind elektrisch geladene Atome oder Moleküle. Die positiv geladenen Ionen werden Kationen genannt, die negativ geladenen Anionen. Da das Wasser stets elektrisch neutral ist (sonst würden wir einen Stromschlag bekommen, wenn wir unsere Hand ins Wasser tauchen), ist die Anzahl der positiven und der negativen Ladungen immer genau gleich.
Ionen können eine oder mehrere Ladungen tragen, gewöhnlich aber nur 1 bis 3. Ionen können aus einem einzelnen Atom bestehen (monoatomische Ionen), oder aus mehreren unlösbar miteinander verknüpften Atomen (polyatomische Ionen), also wie ein geladenes Molekül.
Beispiele:
- Monovalentes Atomkation: das Natriumion Na+
- Divalentes Atomkation: das Calciumion Ca++
- Monovalentes Molekülkation: das Ammoniumion NH4+
- Monovalentes Atomanion: das Chloridion Cl–
- Monovalentes Molekülanion: das Nitration NO3–
- Divalentes Molekülanion: das Carbonation CO3=
- Weiteres divalentes polyatomisches Anion: das Chromation (metallischer Komplex) CrO4=
- Das trivalente monoatomische Aluminiumkation Al+++ existiert nur in stark saurer Lösung, jedoch nicht in natürlichem Wasser.
- Gleicherweise gibt es keine di- oder trivalenten monoatomischen Anionen in normalem Wasser
Ionen bewegen sich im Wasser. Sie sind nicht fixiert, und auch nicht an Ionen der entgegengesetzten Ladung geknüpft. Nur die Summe der Ladungen aller sich in Lösung befindlichen Ionen muss null sein (gleiche Anzahl von Plus- und Minusladungen). Abbildung 1 zeigt schematisch Ionen in Wasser.
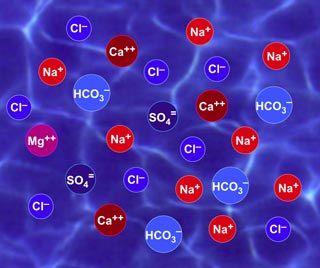
Abb. 1: Ionen sind in Wasser nicht gebunden. Die Summe der Ladungen ist konstant.
Salze sind kristallisierte Stoffe, die Kationen und Anionen in einem bestimmten Verhältnis enthalten. Zum Beispiel hat Kochsalz genau die gleiche Anzahl von Natriumkationen Na+ und Chloridanionen Cl–. Die chemische Formel von Kochsalz ist NaCl. Wenn Sie Salz in Wasser lösen, werden die Kationen und Anionen freigesetzt und wandern frei herum, wie Abbildung 1 zeigt.
Näher betrachtet sind die Ionen im Wasser mit Wassermolekülen verknüpft. Man nennt dies Hydratisierung, wobei die Kationen vom Sauerstoffatom O und die Anionen von den Wasserstoffatomen H angezogen werden, wie in Abbildung 2 gezeigt.
Ionisierte Verbindung in Wasser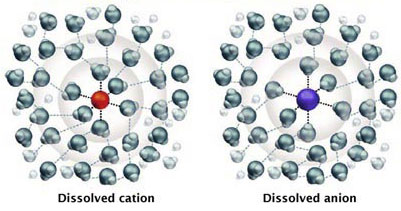
Abb. 2: Hydratisierte Ionen in Wasser — z.B. Kochsalz NaCl: Na+ (rot) und Cl– (blau)
Magnesiumsulfat ist ein Salz mit genau derselben Anzahl an Magnesiumkationen (Mg++, doppelt geladen) wie Sulfatanionen (SO4=, ebenfalls doppelt geladen), so dass die chemische Formel MgSO4 lautet.
Calciumchlorid besteht aus Calciumkationen (Ca++, doppelt geladen) und Choridanionen (Cl—, einfach geladen). Es braucht zwei Chloridionen um ein Calciumion auszubalancieren. Dementsprechend ist die Formel CaCl2.
Ähnlich besteht Natriumcarbonat aus Natriumkationen Na+ und Carbonatanionen CO3=, so dass zwei Natriumionen zum Ausgleich von einem Carbonation notwendig sind, und die Formel ist Na2CO3.
Wenn Sie Wasser verkochen oder vollständig verdunsten lassen, bleibt eine trockene Substanz übrig, welche aus Salzen und möglicherweise auch anderen Stoffen besteht, wie Kieselsäure und organischen Verbindungen. Nur im Meerwasser ist dieser Rückstand beträchtlich bei 35 bis 40 Gramm Trockensubstanz je Liter Wasser. Im Brunnen- oder Oberflächenwasser, aus welchem unser Leitungswasser aufbereitet wird, ist der Trockenrückstand klein, meistens 50 bis 500 mg/L. Dieser Rückstand wird Salzgehalt des Wassers genannt.
Sie können ionisierte Substanzen aus dem Wasser entfernen. Siehe Wasseranalyse und Konzentrationseinheiten im Ionenaustausch (beides auf Englisch). Wichtig ist hier nicht die Masse (g) und auch nicht die Molarität (Mol) sondern die Äquivalentmasse:
1 Val = 1 Mol / Wertigkeit (die internationale Einheit ist eq).
Ein Mol Natrium (Na+) enthält 23 g Metall. Da Natrium monovalent ist entpricht ein eq Na+ auch einer Masse von 23 g. Aber ein Mol Nickel (Ni++) enthält 58.7 g Metall, sodass ein eq Ni++ nur 29.35 g enthält.
Ionenaustausch
Verunreinigungen im Wasser
Wie bereits erwähnt, enthält Wasser kleinere Mengen an Fremdstoffen. In vielen Fällen sind diese Substanzen harmlos. Trinkwasser mit einem gewissen Salzgehalt ist viel gesünder als destilliertes oder ultrareines Wasser. Es gibt aber Bereiche wo diese Fremdstoffe als Verunreinigungen betrachtet und aus dem Wasser entfernt werden müssen.Unlösliche Substanzen (Sand usw.) können mechanisch ausfiltriert werden. Es gibt viele Filtrationsverfahren bis zur Ultrafiltration, welche Teilchen mit einer Größe von weniger als 0,1 µm entfernen können. Für gelöste Stoffe müssen aber andere Verfahren eingesetzt werden.
Sämtliche lösliche ionisierte Stoffe können durch Ionenaustausch entfernt werden.
Ionenaustauscherharze
Ionenaustauscher sind winzige Kunststoffkugeln mit einem Durchmesser von ca. 0,6 mm. Diese Kugeln sind porös und enthalten unsichtbares Wasser, welches als "Feuchtigkeit" gemessen werden kann. Die Struktur dieser Harze ist ein Polymer (wie jeder Kunststoff) auf welchem ein unbewegliches Ion permanent chemisch angebracht wurde. Dieses Ion kann nicht entfernt oder verschoben werden; es ist ein Bestandteil der Harzstruktur und heißt Aktivgruppe. Damit das Harz seine elektrische Neutralität behält, muss jedes dieser unbeweglichen Ionen durch ein Gegenion ins Gleichgewicht gebracht werden. Diese Gegenionen sind beweglich und können innerhalb der Harzkugel sowie zwischen den Harzkugeln und dem umhüllenden Wasser hin und her wandern. Abbildung 3 zeigt die schematische Struktur einer Kationenaustauscher und einer Anionenaustauscherkugel. Die dunklen Linien stellen die Polymermatrix dar, welche porös ist und Wasser enthält. Die festsitzenden Ionen im Kationenaustauscher sind Sulfonate SO3–, die am Polymergerüst verankert sind. Auf diesem Bild sind die roten beweglichen Kationen Natriumionen Na+. Kationenaustauscherharze wie zum Beispiel AmberjetTM 1000 werden oft in der Natriumform geliefert.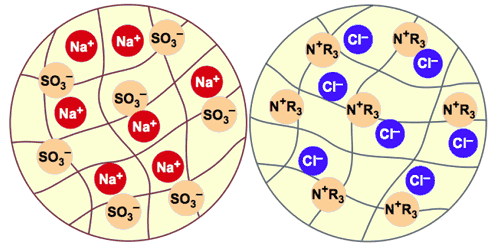
Abb. 3: Schematische Kationen- und Anionenaustauscherharzkugeln
Die Anionenaustauscherkugel hat eine ähnliche Matrix. Die Aktivgruppen sind hier quaternäre Ammoniumionen, welche als N+R3 dargestellt sind obwohl eine genauere aber kompliziertere Formel sie als CH2–N+–(CH3)3 darstellen sollte. Die blauen beweglichen Anionen sind hier Chloridionen (Cl—). Viele Anionenaustauscher werden in der Chloridform geliefert. Jedes Ion, das in die Harzkugel eintritt, muss durch ein anderes Ion gleicher Ladung ersetzt werden, damit die Elektroneutralität beibehalten bleibt. Dies ist genau was man unter Ionenaustausch versteht! Nur Ionen der gleichen Ladung werden ausgetauscht. Es ist nicht möglich, einen Ionenaustauscher zu konzipieren, der gleichzeitig Kationen und Anionen austauschen könnte, denn die festgebundenen Kationen innerhalb der Harzkugeln würden die festgebundenen Anionen in derselben Kugel neutralisieren, und keine Wechselwirkung mit der Außenwelt wäre dann möglich. Deshalb müssen Kationen- und Anionenaustauscher getrennt produziert werden.
Einzelheiten über die Struktur von Ionenaustauscherharzen werden auf einer anderen Seite (auf Englisch) dargestellt.
Wasserenthärtung
Unter den in Wasser gelösten Stoffen ist die Wasserhärte besonders verbreitet. Härte ist ein Begriff der Wasserchemie, welcher hauptsächlich die gelösten Calcium- und Magnesiumionen zusammenfasst. Wenn diese so genannten Erdalkali-Metalle im Wasser anwesend sind, können sie unter Umständen ausfallen und in Ihrem Kochtopf Kalkstein bilden, welchen Sie auch gelegentlich in den Wasserleitungen und in Ihrem Heizkessel finden. Wasserenthärtung ist einfach die Entfernung solcher Kalkstein bildenden Kationen (Ca++ und Mg++) und deren Ersatz durch Natriumionen Na+, welche löslichere Salze bilden und sich deswegen nicht ablagern.
Um Wasser zu enthärten benötigen Sie einen Kationenaustauscher, in welchem die in den Harzkugeln beweglichen Ionen Natriumionen sind (Na+). Dann lassen Sie das "harte" Wasser durch eine Kolonne fließen, welche mit diesem Kationenaustauscher gefüllt ist. Die "harten" Kationen Ca++ und Mg++ dringen in die Harzkugeln ein und verdrängen je zwei Natriumionen Na+ aus der Kugel. Diese Reaktion kann wie folgt geschrieben werden:
2 RNa + Ca++  R2Ca + 2 Na+
R2Ca + 2 Na+
Dies wird in Abbildung 4 illustriert: die Harzkugeln wurden erst mit Natriumionen (Na+) beladen. Jedes Calcium- oder Magnesiumion, welches in die Harzkugel gelangt, wird durch die Verdrängung von zwei Natriumionen kompensiert. Anionen aus dem Wasser (hier nicht gezeigt) können in die Kugel nicht hinein, sonst würden sie durch die unbeweglichen Anionen der Sulfonatgruppen (SO3–) zurückgewiesen.
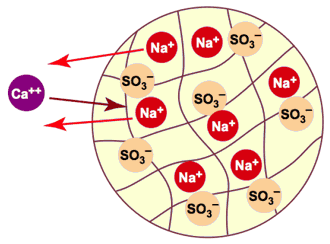
Abb. 4: Enthärtung (Natriumaustausch) in einer Harzkugel
Dieser Kationenaustausch kann deshalb erfolgen, weil der Kationenaustauscher eine höhere Affinität (oder Selektivität) für Calcium- und Magnesium- als für Natriumionen hat: das Harz bevorzugt Ca und Mg auf Kosten von Na. Das Ergebnis der Enthärtung ist nicht die netto Entfernung der härte-bildenden Ionen aus dem Wasser, sondern eher deren Ersatz durch Natriumionen. Der Gesamtsalzgehalt wurde nicht geändert, nur die Zusammensetzung des Salzgehalts.
Offensichtlich kann der Austausch nicht unendlich fortgesetzt werden: wenn der Austauscher so viele Härtekationen aus dem Wasser aufgenommen hat, dass kein Platz mehr in der Harzkugel vorhanden ist, muss der Enthärtungsprozess eingestellt werden. Danach wird der Austauscher entweder durch eine neue Charge ersetzt oder regeneriert.
Entsalzung
Wenn alle Kationen im Wasser durch H+ Ionen und alle Anionen durch OH– Ionen ersetzt werden, rekombinieren diese und bilden neue Wassermolekülen H2O. Um dies zu bewerkstelligen müssen ein Kationenaustauscher in der H+-Form und ein Anionenaustauscher in der OH–-Form eingesetzt werden. Alle Kationen und Anionen werden ausgetauscht, und in diesem Fall "verschwinden" die ionischen Verunreinigungen vollständig. Die Kationenaustauschreaktion ist:
2 R’H + Ca++  R2Ca + 2 H+
R2Ca + 2 H+
R’H + Na+  R’Na + H+
R’Na + H+
In diesen Gleichungen stellt R’ den Kationenaustauscher dar, wie in Abbildung 5 dargestellt. Der Austauscher ist anfänglich in der Wasserstoffform (H+). In diesem Bild werden die Anionen im Wasser nicht gezeigt, wohl aber die Sulfonat-Aktivgruppen SO3–. Ein hereinkommendes Ca++-Ion verdrängt zwei H+ Ionen aus dem Austauscher, während dem ein hereinkommendes Na+-Ion nur ein H+-Ion verdrängt.
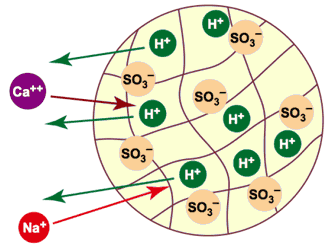
Abb. 5: Entkationisierung (alle Kationen werden durch H+) ersetzt)
In ähnlicher Weise kann ein Anionenaustauscher in der OH– Form alle Anionen aus dem Wasser entfernen. Die Reaktionen sind nun:
R’’OH + Cl–  R’’Cl + OH–
R’’Cl + OH–
2 R’’OH + SO4=  R’’2SO4 + 2 OH–
R’’2SO4 + 2 OH–
wobei R’’ den Anionenaustauscher darstellt. Alle Anionen werden durch Hydroxidionen (OH–) ersetzt. Wir haben hier kein Bild, da das Prinzip dem Kationenaustausch in Abbildung 5 ganz ähnlich ist.
Am Ende dieses doppelten Austauschvorgangs haben die Austauscher alle Kationen und Anionen aus dem Wasser aufgenommen, und dafür H+ und OH– Ionen abgegeben. Die Austauscherkugeln sind fast vollständig erschöpft (Abb. 6 zeigt sie total erschöpft).
Diese H+- und OH–-ionen rekombinieren sofort und bilden Wasser:
H+ + OH–  HOH
HOH  H2O
H2O
Die ionischen Verunreinigungen sitzen nun auf beiden Austauschern (Na und Ca auf dem Kationenaustauscher, Cl und SO4 auf dem Anionenaustauscher) und das Wasser wurde vollentsalzt. Dessen Salzgehalt ist nun extrem gering, nur einige Ionen sind durchgedrungen und bilden den so genannten "Ionenschlupf".
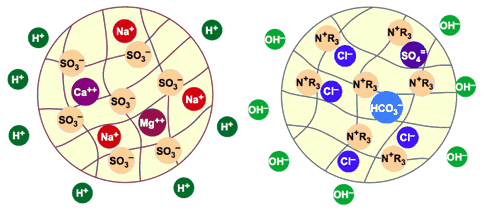
Abb. 6: Beide Austauscher sind erschöpft. H+ und OH– Ionen wurden ins Wasser abgegeben.
Demnach kann Vollentsalzung durch das folgende Bild zusammengefasst werden:
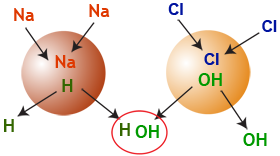
Abb. 7: Vollentsalzung in einem einzigen Bild!!
Regeneration
Wenn die Ionenaustauscher erschöpft sind, können sie zum frischen Anfangszustand mittels Regeneration zurückgebracht werden, und ein neuer Betriebslauf kann durchgeführt werden. Die Regeneration der Ionenaustauscher ist die Umkehrung der Austauschreaktionen, die in den vorigen Abschnitten vorgestellt wurden.
Regeneration eines Enthärters
Zum Beispiel wird der Enthärter mit Natriumionen (Na+) regeneriert, welche von einer Salzlösung (NaCl) geliefert werden. So sieht die Reaktionsgleichung aus:
R2Ca + 2 NaCl  2 RNa + CaCl2
2 RNa + CaCl2

Abb. 8:
Geschirrspülmaschine
Nun haben Sie verstanden, warum Sie Salz in den Geschirrspüler zugeben: das Salz wird mit Wasser verdünnt und regeneriert die — von außen nicht sichtbare — Enthärterpatrone im Gerät, welche üblicherweise unter dem Geräteboden sitzt.
Regeneration einer Entsalzungsanlage
Im Falle der Entsalzung werden starke Säuren, meistens Salzsäure (HCl) oder Schwefelsäure (H2SO4) verwendet. Diese Säuren sind vollständig dissoziiert und können H+-Ionen abgeben, zum Ersatz der Kationen, die aus dem Wasser entfernt wurden und am Ende des Betriebslaufs auf dem Austauscher sitzen:
R’Na + HCl  R’H + NaCl
R’H + NaCl
Zur Regeneration der Anionenaustauscher muss eine starke Base benutzt werden, in der Praxis immer Natronlauge (NaOH), welche OH– Ionen abgeben kann zum Ersatz der Anionen, die jetzt auf dem Austauscher sitzen:
R’’Cl + NaOH  R’’OH + NaCl
R’’OH + NaCl
Aus den letzten zwei Reaktionen ist ersichtlich, dass die Regeneration ein Abwasser produziert, das eine gewisse Salzfracht enthält. Dies ist der größte Nachteil des Ionenaustauschverfahrens.
Siehe die Seite über Regenerationsmethoden (Gleich- und Gegenstrom).
Wie Ionenaustauscherharze aussehen

Ein Muster von AmberliteTM FPC23 |

AmberjetTM Mischbettharze |

AmberjetTM 4400 |
| Abb. 9: Ionenaustauscher sehen so aus (klicken Sie die Bildchen an) | ||
Weitere Fotos unter dem Mikroskop sehen Sie hier.
Säulenbetrieb
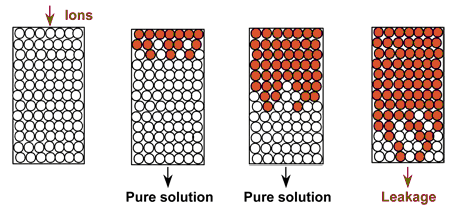
Abb. 10: Der Austauscher nimmt Ionen aus der einfließenden Lösung auf
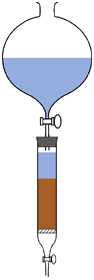
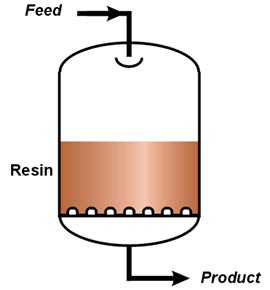
Die nächsten Bilder zeigen eine typische Laborsäule, eine einfache industrielle Säule und das Foto einer realen AmberpackTM Anlage.
 |
 |
 |
| Laboreinrichtung | Industrielle Säule | AmberpackTM Behälter |
| Abb. 11: Typische Ionenaustauscherkolonnen | ||
Die Karaffe am Anfang dieser Seite enthält ein kleines Filter, welches mit Aktivkohle und Ionenaustauscherharz gefüllt ist. Die Harzmenge ist ca. 150 ml. Zum Vergleich enthält ein großer industrieller Ionenaustauschbehälter bis zu 20'000 L Harz, seltener auch noch mehr.
Austauschkapazität
Totale Kapazität
Die Anzahl von Aktivgruppen eines Ionenaustauscherharzes ist seine totale Kapazität. Da jedes einzelne Harzkorn Milliarden von Aktivgruppen enthält, wird die Kapazität gewöhnlich in Äquivalenten pro Liter (val/L oder eq/L) angegeben. Ein Äquivalent besteht aus 6,02×1023 Aktivgruppen. Diese große Zahl — die sogenannte Avogadro-Zahl — müssen Sie jedoch nicht in Erinnerung behalten; sie soll Ihnen lediglich zu einer Vorstellung der Größenordnung verhelfen.
Ein typischer stark saurer Kationenaustauscher hat eine totale Kapazität von 1,8 bis 2,2 val/L
Ein typischer schwach saurer Kationenaustauscher hat eine totale Kapazität von 3,7 bis 4,5 val/L
Ein typischer schwach oder stark basischer Anionenaustauscher hat eine totale Kapazität von 1,1 bis 1,4 val/L
Die Ionenaustauschertypen werden hier (auf Englisch) beschrieben.
Nutzbare Volumenkapazität (NVK)
Im Bild "Säulenbetrieb" des letzten Abschnittes ist das Harz am Anfang des Betriebslaufs völlig (100 %) regeneriert, aber nicht völlig erschöpft am Ende des Betriebslaufs. Die Definition der nutzbaren Kapazität ist die Differenz zwischen den regenerierten Aktivgruppen am Anfang und am Ende des Betriebslaufs. Sie wird auch in val/L gemessen.
Im Betrieb beträgt die nutzbare Kapazität etwa die Hälfte der totalen Kapazität. Der praktische Bereich liegt zwischen 40 und 70 % und hängt von den Betriebsbedingungen ab. Siehe weitere Informationen auf einer separaten Seite.
 Das Wichtige beim Ionenaustausch ist die Anzahl der Ionen und deren Ladung, nicht ihre Masse oder ihr Gewicht. Demnach müssen in allen Wasseranalysen die einzelnen Ionenmassen (mg/L) in Äquivalenten (mval/L) umgerechnet werden.
Das Wichtige beim Ionenaustausch ist die Anzahl der Ionen und deren Ladung, nicht ihre Masse oder ihr Gewicht. Demnach müssen in allen Wasseranalysen die einzelnen Ionenmassen (mg/L) in Äquivalenten (mval/L) umgerechnet werden.Warum werden Ionenaustauschermengen in Volumen ausgedrückt?
Zur Dimensionierung einer Ionenaustauscherkolonne braucht man das Volumen der berücksichtigten Harzmenge, nicht ihre Masse. Ionenaustauscher haben verschiedene Dichten (siehe die Seite über Harzeigenschaften), so dass die Harze per Volumen verkauft werden (in Litern oder Kubikmetern). Viele der Harzeigenschaften beziehen sich auch auf das Volumen.
Qualität des aufbereiteten Wassers
In einer typischen Vollentsalzungsanlage beträgt die Reinwasserqualität — als Leitfähigkeit ausgedrückt — 1 µS/cm oder weniger. Wenn man bedenkt, dass Rohwasser aus einem Fluss oder Brunnen eine Leitfähigkeit von 100 bis 1000 µS/cm aufweist ist der Wirkungsgrad des Verfahrens 99 bis 99,9 %, manchmal sogar noch höher. Andere Verfahren — z.B. Umkehrosmose — liegen weit in ihrem Wirkungsgrad dahinter.
Grenzen des Ionenaustauschs
Damit das Ionenaustauschverfahren wirksam ist muss ein Affinitätsunterschied existieren zwischen dem Ion auf dem Austauscher und dem Ion, welches aus dem Wasser entfernt werden soll. Der Austauscher muss nämlich eine höhere Affinität aufweisen für das Ion in Lösung als für das Ion im Harz.
Ionenaustausch ist das perfekte Verfahren zur Entfernung oder zum Austausch von Verunreinigungen, die in niedriger Konzentration vorliegen. In solchen Fällen ist die Beladungszeit lang, in einem Bereich von einigen Stunden bis mehreren Monaten. Bei Gewässern oder Lösungen mit hohem Salzgehalt, z.B. mehrere Gramm pro Liter, wird der Zyklus sehr kurz, und der Verbrauch an Regeneriermitteln wächst zu unwirtschaftlichen Werten an. Brackwasser zum Beispiel wird nicht mit Ionenaustausch entsalzt, sondern durch Destillation oder Umkehrosmose.
Verunreinigungen, die nicht ionisiert im Wasser bzw. in der Lösung vorliegen, können nicht durch Ionenaustausch entfernt werden. Andere Trennverfahren müssen in diesen Fällen eingesetzt werden, unter anderem Aktivkohle, nicht-ionogene Adsorber, Molekularsiebe und Membranverfahren.
Selektiver Ionenaustausch
Auf Grund von Affinitätsunterschieden zwischen verschiedenen Ionen können herkömmliche Ionenaustauscher für die selektive Entfernung von gewissen Ionen aus dem Wasser eingesetzt werden. Das Musterbeispiel ist hier Enthärtung. Mit Umkehrosmose kann Wasser nicht gut enthärtet werden: man muss es teilweise entsalzen. Hingegen kann Ionenaustausch die Härteionen Ca++ und Mg++ mit HIlfe eines Austauschers in der Na+ Form entfernen. Ähnlich können andere Ionen aus dem Wasser entfernt werden: Nitrat und Sulfat werden z.B. mit einem Anionenaustauscher in der Chloridform entfernt. Es funktioniert deshalb, weil der Anionenaustauscher eine höhere Affinität für das Nitrat- oder Sulfation als für das Chloridion aufweist. Die Affinitätsskala ist:
SO4= > NO3– > Cl– > HCO3– > OH– > F–
Es gibt also keine Methode — auch nicht mit anderen Verfahren — das Chlorid aus Wasser zu entfernen, ohne andere Ionen anzutasten.
Für Kationenaustauscher (Enthärtertypen) ist die Affinitätsskala:
Pb++ > Ca++ > Mg++ > Na+ > H+
Das Pb (Blei) wird hier aufgeführt um zu zeigen, dass gelöstes Blei sehr wirksam von einem Enthärter aufgenommen wird, sowie viele andere Schwermetalle (obwohl nicht alle). Siehe Selektivitätstabellen für Kationen and Anionen.
Manche Schadstoffe sind aber mit herkömmlichen Ionenaustauschern nur schwer zu entfernen. Dafür wurden gezielt verschiedene Spezialaustauscher zur selektiven Aufnahme dieser Schadstoffe entwickelt. Selektive Ionenaustauscherharze sind heutzutage erhältlich für die Entfernung von:
- Bor
- Nitrat
- Perchlorat
- Cadmium, Quecksilber und anderen Schwermetallen
- Nickel
- Chromat
Außerhalb der Wasseraufbereitung
Es existieren viele Anwendungen in anderen Bereichen. Einige Beispiele sind:
- Enthärtung von Rübenzuckerdünnsaft
- Entfärbung von Rohrzuckersäften
- Chromatographische Trennung von Glukose und Fruktose
- Entsalzung von Molke, Glukose und vielen anderen Lebensmittelprodukten
- Rückgewinnung von Polyphenolen für die Lebensmittelindustrie
- Rückgewinnung von Uran aus dessen Erzen
- Goldrückgewinnung aus Vergoldungsbädern
- Trennung von Metallen in Lösung
- Reinigung von galvanischen Bädern
- Katalyse der Synthese von Antiklopfmitteln für Benzin
- Gewinnung von Antibiotika und anderen Verbindungen aus Gärungsbrühen
- Reinigung von organischen Säuren
- Gemahlene Ionenaustauscherharze werden in pharmazeutischen Tabletten gebraucht
Schlussfolgerung
 Der Ionenaustausch ist ein sehr leistungsfähiges Verfahren, um Verunreinigungen und Schadstoffe aus Wasser und anderen Lösungen zu entfernen. Viele Industrien verlassen sich auf Ionenaustausch um extrem reines Wasser herzustellen. Darunter:
Der Ionenaustausch ist ein sehr leistungsfähiges Verfahren, um Verunreinigungen und Schadstoffe aus Wasser und anderen Lösungen zu entfernen. Viele Industrien verlassen sich auf Ionenaustausch um extrem reines Wasser herzustellen. Darunter:
- Kernkraftwerke
- Kraftwerke mit Öl-, Gas- und Kohlefeuerung
- Halbleiterproduktion
- Flachbildschirme
- Selektive Entfernung von Schadstoffen aus Trinkwasser
Besuchen Sie die Sitemap, um weitere Detailseiten über Anwendungen, Harzeigenschaften und Einsatzmöglichkeiten zu entdecken.
Amberjet, Amberlite und Amberpack sind Warenzeichen von Rohm and Haas, einer Tochtergesellschaft der Dow Chemical Company.










