Procesos básicos de intercambio iónico
en el tratamiento de agua
Introducción
Varias tecnologías de intercambio iónico existen para tratar aguas:
- Ablandamiento (o suavización, eliminación de la dureza)
- Descarbonatación (eliminación del bicarbonato)
- Descarbonatación y ablandamiento combinados
- Descationización (eliminación de todos los cationes)
- Desmineralización (eliminación de todos los cationes y aniones)
- Lecho mezclado o lecho mixto, pulido final
- Eliminación de nitratos
- Eliminación selectiva de varios contaminantes
Ablandamiento
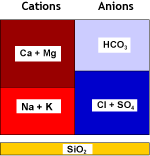
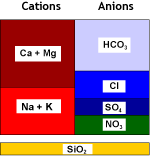
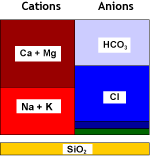
Aguas naturales contienen iones de calcio y de magnesio (véase análisis de agua) que forman sales no muy solubles. Estos cationes, así como el estroncio y el bario que son menos comunes y aún menos solubles, se llaman iones de dureza. Cuando se evapora el agua, estos cationes pueden precipitar. Eso es lo que se puede observar cuando bulle agua en el hervidor de la cocina.
El agua dura produce incrustaciones en tuberías y calderas domésticas e industriales. Puede crear turbidez en la cerveza o bebidas gaseosas. Las sales de calcio ensucian vasos en su lavaplatos si la dureza del agua municipal es alta o si olvidó adicionar sal.
Las resinas intercambiadoras de cationes fuertemente ácidas (SAC, véase tipos de resina) usadas en forma de sodio eliminan los cationes de dureza del agua. Columnas de ablandamiento agotadas con estos cationes se regeneran con cloruro de sodio (NaCl, sal común).
Reacciones
Aquí el ejemplo del calcio:
2 R-Na + Ca++ 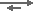 R2-Ca + 2 Na+
R2-Ca + 2 Na+
R representa la resina, la cual está inicialmente en forma sodio. La reacción con el magnesio es idéntica.
Esta reacción es un equilibrio. Se puede invertir aumentando la concentración de sodio en el lado derecho. Eso se hace con NaCl y la reacción de regeneración es:
R2-Ca + 2 Na+ 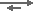 2 R-Na + Ca++
2 R-Na + Ca++
¿Qué ocurre en el agua?
 Agua bruta |
SAC (Na) |
 Agua ablandada |
La salinidad del agua es igual que antes, pero contiene ahora sodio en lugar de dureza. Un pequeño residuo de dureza permanece, que depende de las condiciones de regeneración.
| Regeneración en co-corriente | Depende de la calidad del agua bruta y del nivel de regeneración |
| Regeneración en contra-corriente | < 0.02 meq/l (1 mg/l como CaCO3) |
Usos
Ejemplos de uso de ablandadores:
- Tratamiento de agua para calderas de baja presión
- En Europa, muchos lavaplatos tienen un cartucho de resina ablandadora en el fondo de la máquina
- Cervecerías y productores de refrescos tratan el agua de producción con resinas de calidad alimentaria
Descarbonatación
Este proceso emplea una resina intercambiadora de cationes débilmente ácida (WAC), que es capable de eliminar dureza del agua cuando esa tiene alcalinidad (es decir bicarbonatos). El agua tratada tiene gas carbónico libre que se puede eliminar en una torre desgasificadora. La resina se regenera muy fácilmente con un ácido fuerte, preferentemente ácido clorhídrico.
Reacciones
Aquí el ejemplo del calcio:
2 R-H + Ca++(HCO3–)2  R2-Ca + 2 H+ + 2 HCO3–
R2-Ca + 2 H+ + 2 HCO3–
después, los cationes de hidrógeno se combian con los aniones de bicarbonato y producen ácido carbónico y agua:
H+ + HCO3–  CO2 + H2O
CO2 + H2O
¿Qué ocurre en el agua?
 Agua bruta |
WAC (H) |
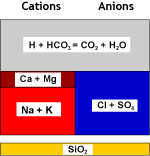 Agua descarbonatada |
| Recombinación del hidrógeno con el bicarbonato y eliminación del dióxido de carbono en la torre de desgasificación: | ||
 Agua descarbonatada |
DEG |
 Agua desgasada |
| Dureza temporal | Prácticamente 0 |
| Dureza total | = SAF |
| pH | 6 — 7 |
La salinidad ha sido reducida. La dureza temporal ha desaparecido.
Usos
La descarbonatación sirve:
- En cervecerías
- En cartuchos domésticos de agua potable
- Para calderas de baja presión
- Como primera etapa de una desmineralización
Descarbonatación y ablandamiento combinados
A veces se llama este proceso Carbomix, aunque las resinas no están mezcladas. Emplea dos tipos de resina: un WAC (débilmente ácido) en forma H+ seguido por un SAC (fuértemente ácido) en forma Na+. Las dos resinas se pueden colocar en la misma columna (en Stratabed), o en columnas separadas. Este sistema solo es útil si la dureza total (TH) supera la alcalinidad (TAC). En caso contrario, la resina WAC es suficiente.
Las reacciones de intercambio se presentan en los dos párrafos anteriores, y no las repetiremos aquí. Para que el sistema funcione, la descarbonatación debe ocurrir primero.
¿Qué ocurre en el agua?
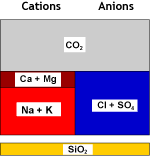
El primer paso es la descarbonatación, que es la eliminación de la dureza temporal:
 Eau brute |
WAC (H) |
 Agua descarbonatada |
El segundo paso es la eliminación de la dureza residual (dureza permanente). El CO2 producido puede ser desgasificado.
 Agua descarbonatada |
SAC (Na)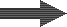 |
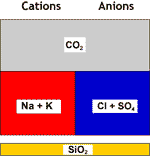 Descarbonatada+ablandada |
DEG |
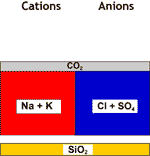 Agua final |
Toda la dureza ha desaparecido, y la salinidad ha bajado.
| Dureza total | 0.02 - 0.2 meq/L |
| Na | Concentración reducida al nivel del SAF |
| pH | 6 - 7 |
| SAF | No cambio |
| CO2 | 0.2 - 0.3 meq/L |
La regeneración se hace en dos pasos, empezando con el ácido (preferiblemente HCl), luego la salmuera.
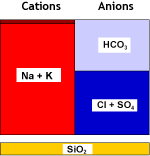
Descationización
La eliminación de todos los cationes no es un proceso individual muy corriente, sino como primera etapa de un tratamiento de condensados ante un lecho mezclado. Se hace con una resina intercambiadora de cationes fuértemente ácida (SAC) en forma H+.
Reaciones
Aquí el ejemplo del sodio, pero todos los cationes reaccionan igual. Es una reacción de equilibrio:
R-H + Na+ 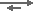 R-Na + H+
R-Na + H+
La reacción inversa (de regeneración) ocurre aumentando la concentración de hidrógeno en el lado derecho. Se hace con un ácido fuerte, HCl o H2SO4:
R-Na + H+ 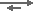 R-H + Na+
R-H + Na+
¿Qué ocurre en el agua?
 Agua bruta |
SAC (H) |
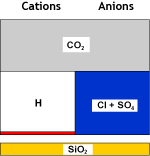 Agua descationizada |
DEG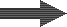 |
 Descationizada y desgasada |
En la segunda etapa, una torre de desgasificación elimina aquí tambien el dióxido de carbono, combinandp los aniones de bicarbonato y los cationes de hidrógeno producidos en la primera etapa. La salnidad del agua ha sido reducida y el agua tratada es ácida. Una pequeña fuga de sodio permanece (en rojo en la imagen).
| Dureza total | 0 |
| Na (regen. co-corriente) | 0.5 — 1 mg/L |
| Na (regen. contra-corriente) | < 0.1 mg/L |
| pH | 2 — 5 |
| SAF | Sin cambio |
| CO2 | 0.2— 0.3 meq/L |
Desmineralización
En muchas aplicaciones se deben eliminar todos los iones del agua. Cuando se calienta agua para producir vapor, cualquiera impureza en ella puede precipitar y causar daño. Como hay cationes y aniones en el agua bruta (en concentración globalmente igual), se deben usar dos tipos de resina: un intercambiador de cationes y un intercambiador de aniones. Esta combionación produce agua pura, como ya se ha presentado en la introducción general. La desmineralización se puede también llamar desionización. La resina catiónica se usa en forma hidrógeno (H+) , y la anionica en forma hidróxido (OH–), de manera que se regenera la catiónica con un ácido y la aniónica con un álcali.
El dióxido de carbono se elmina con una torre desgasificadora cuando el agua contiene una concentración apreciable de bicarbonato.
 En general, el intercambiador de cationes está colocado en primer sitio, delante del intercambiador de aniones. Si no fuese así, los cationes de dureza precipitarían en el medio ambiente alcalino de la resina aniónica en forma de Ca(OH)2 o de CaCO3, que tienen baja solubilidad.
En general, el intercambiador de cationes está colocado en primer sitio, delante del intercambiador de aniones. Si no fuese así, los cationes de dureza precipitarían en el medio ambiente alcalino de la resina aniónica en forma de Ca(OH)2 o de CaCO3, que tienen baja solubilidad.
Arreglo SAC – (DEG) – SBA
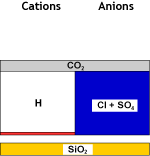
Examinemos primero un sistema sencillo de desmineralización con una resina fuértemente ácida (SAC) en forma H+, una torre de desgasificación (opcional) y una resina fuértemente básica (SBA) en forma OH–. La primera etapa del proceso es la descationización (véase arriba):RSAC-H + Na+  RSAC-Na + H+
RSAC-Na + H+
En el caso de calcio en lugar de sodio (válido también para magnesio y otros cationes divalentes):
2 RSAC-H + Ca++  (RSAC)2-Ca + 2 H+
(RSAC)2-Ca + 2 H+
En la segunda etapa del proceso, todos los aniones son eliminados por la resina básica fuerte:
RSBA-OH + Cl– 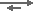 RSBA-Cl + OH–
RSBA-Cl + OH–
Los ácidos débiles producidos en la etapa de descationización, que son el ácido carbónico y silícico (H2CO3 y H2SiO3) se eliminan de la misma manera:
RSBA-OH + HCO3– 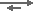 RSBA-HCO3– + OH–
RSBA-HCO3– + OH–
Y al final, los iones H+ producidos en la primera etapa reaccionan con los iones OH– de la segunda y forman nuevas moléculas de agua. Esta reacción es irreversible:
H+ + OH–  H2O
H2O
¿Qué ocurre en el agua?
| Intercambio de cationes (idéntico a la descationización de arriba): | ||||
 Agua bruta |
SAC (H) |
 Agua descationizada |
DEG |
 Descationizada y degasada |
| Intercambio de aniones: | ||||
 Agua descat. y desgasada |
SBA (OH)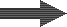 |
 Agua desmineralizada |
||
| Conductividad (regen. co-corriente) | 5 — 25 µS/cm |
| Conductividad (regen. contra-corriente) | < 1 µS/cm |
| Sílice residual (co-corriente) | 50 — 200 µg/L |
| Sílice residual (contra-corriente) | 5 — 40 µg/L |
| Sodio residual | Véase descationización arriba |
| pH | En principio > 7 No se puede utilizar el pH como criterio de operación |
El agua desmineralizada no contiene iones, excepto pequeñas trazas de sodio y de sílice, porque las resinas SAC y SBA tienen una menor selectividad para ellos. Con tal cadena sencilla de desmineralización regenerada en contra-corriente se obtiene un agua desmineralizada con una conductividad de solo 1 µS/cm aproximadamente, y una sílice residual de 5 a 50 µg/L, un valor que depende de la concentración de sílice en el agua bruta y de las condiciones de regeneración.
El pH del agua tratada no se puede medir en agua desmineralizada. Los valores indicados con un pH-metro son erróneos cuando la conductividad es baja.
Regeneración
La resina fuértemente ácida (SAC) se regenera con un ácido fuerte, HCl o H2SO4:
R-Na + H+ 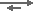 R-H + Na+
R-H + Na+
Y la resina fuértemente básica (SBA) se regenera con una base fuerte, NaOH en 99 % de los casos:
RSBA-Cl + OH– 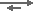 RSBA-OH + Cl–
RSBA-OH + Cl–
Arrreglo WAC/SAC – DEG – WBA/SBA
Las resinas débilmente ácidas (WAC) y débilmente básicas (WBA) ofrecen una capacidad útil alta y se regeneran muy fácilmente. Entonces se emplean tales resinas en combinación con resinas fuértemente ácidas (SAC) y básicas (SBA) en plantas grandes, para lograr un mejor rendimiento químico y un consumo de regenerantes más bajo. La primera etapa con la resina WAC es una descarbonatación (eliminación de la dureza temporal), y la segunda etapa elimina todos los demás cationes. Las resinas débilmente ácidas WAC se emplean cuando el agua bruta tiene concentraciones relativamente altas de dureza y de alcalinidad.Las resinas débilmente básicas (WBA) eliminan solo los ácidos fuertes detrás de la etapa de descationización. No son capaces de eliminar los ácidos débiles que son SiO2 y CO2. En su forma regenerada, no son disociadas, y entonces no tienen iones OH– libres que se necesitan para un intercambio de aniones neutrales. Por el otro lado, su basicidad es suficiente para eliminar los ácidos fuertes creados por el intercambio de cationes.
RWBA + H+Cl–  RWBA.HCl
RWBA.HCl
En la última etapa, una resina fuértemente básica (SBA) es necesaria para eilminar los ácidos débiles como ya se ha mencionado en el párrafo anterior:
RSBA-OH + HCO3– 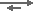 RSBA-HCO3– + OH–
RSBA-HCO3– + OH–
¿Qué ocurre en el agua?
| Intercambio catiónico empezando por una descarbonatación seguida por la eliminación de todos los demás cationes: | ||||
 Agua bruta |
WAC (H) |
 Agua descarbonatada |
SAC (H) |
 Agua descationizada |
| Intercambio aniónico empezando por la eliminación de los ácidos fuertes después de una desgasificación: | ||||
 Agua descationizada y desgasada |
WBA (FB) |
 Agua parcialmente desmineralizada |
SBA (OH) |
 Agua totalmente desmineralizada |
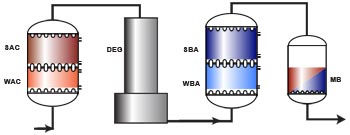
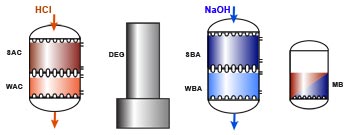
La imagen siguiente es una cadena completa de desmineralización, incluyendo una columna de intercambio catiónico de dos cámaras (WAC y SAC), una torre de desgasificación, una columna de intercambio aniónico de dos cámaras (WBA y SBA), y un lecho mezclado como pulido final. El uso de la resina débilmente ácida (WAC) y de la torre de desgasificación depende de la concentración de dureza y de alcalinidad en el agua bruta, como mencionado en los párrafos anteriores.
Regeneración
La regeneración se hace en serie: la solución regenerante pasa primero por la resina fuerte y después por la resina débil; en general, el regenerante no consumido por la resina fuerte basta para regenerar la débil.
Las resinas intercambiadoras de cationes se regeneran con un ácido fuerte, preferentemente HCl porque H2SO4 puede precipitar sulfato de calcio.
Las resinas intercambiadoras de aniones se regeneran con sosa cáustica.
La calidad del agua tratada es la misma que la obtenida con el arreglo sencillo SAC—SBA, pero el consumo de regenerantes es más bajo porque las resinas débiles se regeneran prácticamente sin costo. Además, las resinas débiles tienen más capacidad que las fuertes, así que el volumen total de resinas es reducido.
Usos
Ejemplos de desmineralización:
- Agua para calderas de alta persión en centrales eléctricas nucleares o térmicas y en otras industrias. Véase también Condensate polishing (en inglés).
- Agua de proceso en varias aplicaciones de las industrias químicas, de tejidos y de papel.
- Agua para baterías.
- Agua para laboratorios.
- Agua de lavado en la producción de semiconductores y otros productos electrónicos. Véase Ultrapure water (en inglés).
Lechos mezclados de pulido
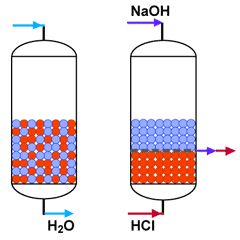
Un lecho mixto en producción
y en regeneración
Los lechos mezclados producen un agua de calidad excelente, pero son difíciles de regenerar, porque hay que separar las resinas antes de regenerarlas. Además, precisan de cantidades elevadas de regenerantes, y las condiciones hidráulicas de regeneración no son óptimas. Entonces los lechos mezclados se usan príncipalmente para el tratamiento de agua pre-desmineralizada o de baja salinidad, cuando los ciclos son largos.
¿Qué ocurre en el agua?
No queda casi nada en el agua tratada:
 Agua pre-desmineralizada |
SAC (H) + SBA (OH) |
 No queda nada |
Los lechos mezclados de pulido producen agua con una conductividad de menos de 0,1 µS/cm. Con un diseño óptimo y resinas apropiadas se puede alcanzar la conductividad del agua pura (0,055 µS/cm). La sílice residual puede ser 1 µg/L, a veces menos.
El pH del agua tratada no se puede medir en agua desmineralizada. Los valores indicados con un pH-metro son erróneos cuando la conductividad es menor que 1 µS/cm.
| Conductividad | < 0.1 µS/cm |
| Sílice residual | 1 — 10 µg/L |
| pH | No se puede medir |
Usos
- Pulido de agua pre-desmineralizada con resinas
- Pulido de permeado de ósmosis inversa
- Pulido de agua de mar destilada
- Pulido de condensados de turbina en centrales eléctricas
- Tratamiento de condensados de proceso en varias industrias
- Producción de agua ultrapura en la industria de semiconductores
- Desmineralización de cartuchos (con regeneración externa)
Capacidad y tiempo de producción
El schema y la calidad del agua tratada del párrafo anterior son válidos para un pulido detrás de un sistema primario de desmineralización de intercambio iónico. En este caso, el agua de entrada del lecho mezclado contiene solo trazas de sodio y de sílice. La capacidad útil es entonces limitada por el iontercambiador de aniones, la que es muy baja. No obstante, el tiempo de producción con un agua de alimentación de 1 µS/cm es generalmente de 2 a 4 semanas.
Si el agua de alimentación del lecho mezclado contiene otros iones, por ejemplo detrás de una ósmosis inversa, la situación es totalmente distinta. En este caso, el agua osmotizada contiene a menudo una larga proporcion de gas carbónico, la que limita la capacidad del pulidor. Por otro lado, la calidad del agua tratada es muchas veces más de 0.1 µS/cm (pero menos que 1 µS/cm), y el tiempo de producción solo es de un día hasta unos días.
Eliminación de nitrato
La eliminación selectiva de nitratos en agua potable se puede hacer con resina fuértemente básicas (SBA) en ciclo cloruro, es decir con regeneración con una salmuera de NaCl. La reacción de intercambio es:
RSBA-Cl + NO3–  RSBA-NO3 + Cl–
RSBA-NO3 + Cl–
¿Qué ocurre en el agua?
 Agua bruta |
SBA (Cl) |
 Agua desnitratada |
Se puede usar resinas SBA convencionales, pero ellas también eliminan sulfatos. Véase la tabla de selectividad. En función del tipo de resina, una pequeña parte (resinas selectivas) o todo el sulfato (resinas convencionales) desaparece. El bicarbonato es eliminado parcialmente en la primera parte del ciclo.
Usos
- Principalmente tratamiento de aguas municipales
Eliminación selectiva de varios otros contaminantes
La eliminación selectiva de metales y otros contaminantes es importante en los casos de agua potable y de aguas de desecho. Muchas de estas aplicaciones necesitan resinas especiales, por ejemplo resinas quelatantes que forman complejos estables con metales.
Ejemplos
- Eliminación de boro (ácido bórico) en agua potable
- Eliminación de nitrato en agua potable (párrafo anterior)
- Eliminación de perchlorate en agua potable
- Eliminación de metales pesantes en vertidos: Cd, Cr, Fe, Hg, Ni, Pb, Zn
Algunos contaminantes no se pueden eliminar fácilmente por intercambio iónico, por ejemplo As, F, Li. Véase el sistema periódico de los elementos con algunos datos de intercambio iónico. Véase también la página de los tipos de resina (resinas selectivas) y una página aparte sobre el tratamiento de agua potable.
Más información
Abreviaturas
Usamos las abreviaturas siguientes para los tipos de resina:
- SAC: resina fuértemente ácida (Strongly Acidic Cation exchange resin)
- WAC: resina débilmente ácida (Weakly Acidic Cation exchange resin)
- SBA: resina fuértemente básica (Strongly Basic Anion exchange resin)
- WBA: resina débilmente básica (Weakly Basic Anion exchange resin)
Agua
Véase detalles sobre el análisis de agua necesitado para calcular los procesos de esta página, y una página separada con aplicaciones en agua potable.
Columnas de intercambio iónico
Varios tipos de columnas están en una página en inglés con muchas gráficas. También torres de desgasificación y algunos principios de diseño.
Regeneración
Véase detalles sobre los procesos de regeneración con cantidades y concentraciones de regenerantes.
Reacciones de intercambio
Una página separada en inglés describe el equilibrio y las reacciones químicas de las resinas.